Definisi Atom
- Salah satu konsep ilmiah tertua adalah bahwa semua materi dapat dipecah menjadi zarah (partikel) terkecil, dimana partikel-partikel itu tidak bisa dibagi lebih lanjut.
- Atom berasal dari kata: A : Tidak, Tomos : memotong. Dinamakan atom karena dianggap tidak dapat dipecah lagi
Teori Atom Dalton (1743 – 1844)
 |
| model atom dalton |
John
Dalton mengemukakan hipotesa tentang atom berdasarkan hukum kekekalan
massa (Lavoisier) dan hukum perbandingan tetap (Proust).
Teori yang diusulkan Dalton:
Percobaan LavoisierTeori yang diusulkan Dalton:
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
- Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda.
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen.
- Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Hipotesa
Dalton digambarkan dengan model atom sebagai bola pejal seperti ada
tolak peluru. Teori atom Dalton tidak dapat menerangkan suatu larutan
dapat menghantarkan listrik. Bagaimana mungkin suatu bola pejal dapat
menghantarkan listrik, padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menyebabkan terjadinya daya hantar listrik.
| percobaan lavoisier |
Mula-mula
tinggi cairan merkuri dalam wadah yang berisi udara adalah A, tetapi
setelah beberapa hari merkuri naik ke B dan ketinggian ini tetap. Beda
tinggi A dan B menyatakan volume
udara yang digunakan oleh merkuri dalam pembentukan bubuk merah (merkuri
oksida). Untuk menguji fakta ini,
Lavoisier mengumpulkan merkuri oksida, kemudian dipanaskan lagi. Bubuk
merah ini akan terurai menjadi cairan merkuri dan sejumlah volume
gas (oksigen) yang jumlahnya sama dengan udara yang dibutuhkan dalam
percobaan pertama
Model Atom J.J Thompson
 |
| Model atom Thompson yang berbentuk seperti roti kismis |
Kelemahan dari Dalton diperbaiki oleh JJ. Thomson, eksperimen yang
dilakukannya tabung sinar kotoda. Hasil eksperimennya menyatakan ada
partikel bermuatan negatif dalam atom yang disebut elektron. Thomson
mengusulkan model atom seperti roti kismis atau kue onde-onde. Suatu
bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang
bermuatan positif sehingga atom bersifat netral.
| percobaan sinar katoda |
Kode C = Katoda; A = Anoda; E = lempeng kondensor bermuatan listrik; M =magnet; F = layar berfluoresens.
Berkas 1 : Hanya dengan adanya medan listrik, berkas sinar katoda dibelokkan keatas menyentuh layar pada titik 1.
Berkas 2 : Hanya dengan adanya medan magnit, berkas sinar katoda dibelokkan kebawah menyentuh layar pada titik 2.
Berkas 3 : Berkas sinar katoda akan lurus dan menyentuh layar dititik 3, bila medan listrik dan medan magnit sama besarnya
Berkas 1 : Hanya dengan adanya medan listrik, berkas sinar katoda dibelokkan keatas menyentuh layar pada titik 1.
Berkas 2 : Hanya dengan adanya medan magnit, berkas sinar katoda dibelokkan kebawah menyentuh layar pada titik 2.
Berkas 3 : Berkas sinar katoda akan lurus dan menyentuh layar dititik 3, bila medan listrik dan medan magnit sama besarnya
Berdasarkan eksperimennya Thomson mengukur bahwa kecepatan sinar katoda jauh lebih kecil dibandingkan kecepatan cahaya, jadi sinar katoda ini bukan merupakan REM. Selain itu ia juga menetapkan perbandingan muatan listrik (e) dengan massa (m). Hasil rata-rata e/m sinar katoda kira-kira 2 x 10^8 Coulomb per gram. Nilai ini sekitar 2000 kali lebih besar dari e/m yang dihitung dari hidrogen yang dilepas dari elektrolisis air (Thomson menganggap sinar katoda mempunyai muatan listrik yang sama seperti atom hidrogen dalam elektrolisis air.
Kesimpulan : Partikel sinar katoda bermuatan negatif dan merupakan partikel dasar suatu benda yang harus ada pada setiap atom. Pada tahun 1874 Stoney mengusulkan istilah elektron .
Kelemahan model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
Model Atom Rutherford
 |
| Model atom Rutherford |
Eksperimen yang dilakukan Rutherford adalah
penembakan lempeng tipis dengan partikel alpha. Ternyata partikel itu
ada yang diteruskan, dibelokkan atau dipantulkan. Berarti di dalam atom
terdapat susunan-susunan partikel bermuatan positif dan negatif.
Hasil
pengamatan tersebut dikembangkan dalam hipotesis model atom Rutherford.
a. Sebagian besar dari atom merupakan permukaan kosong.b. Atom memiliki inti atom bermuatan positif yang merupakan pusat massa atom.
c. Elektron bergerak mengelilingi inti dengan kecepatan yang sangat tinggi.
d. Sebagian besar partikel α lewat tanpa mengalami pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
Kelemahan Model Atom Rutherford
a. Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
b. Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap inti atom.
c. Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
d. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
Kelemahan
dari Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke
dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari
inti ini disertai pemancaran energi sehingga lama – kelamaan energi
elektron akan berkurang dan lintasannya makin lama akan mendekati inti
dan jatuh ke dalam inti
Model Atom Niels Bohr
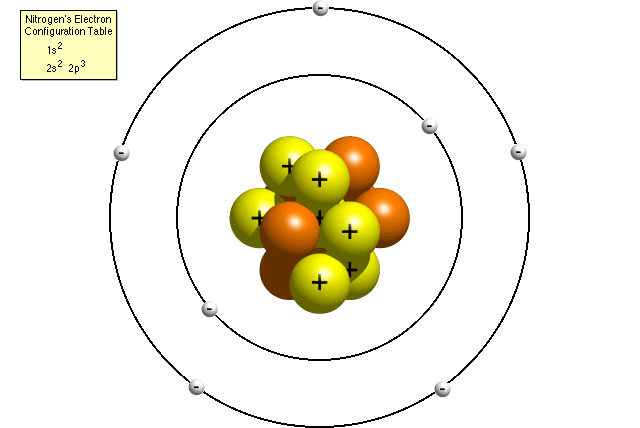 |
| Model atom Niels Bohr |
Kelemahan dari Rutherford diperbaiki oleh Niels Bohr dengan percobaannya
menganalisa spektrum warna dari atom hidrogen yang berbentuk garis.
Hipotesis Bohr adalah :
Hipotesis Bohr adalah :
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.
Jika
berpindah lintasan ke lintasan yang lebih tinggi maka elektron akan
menyerap energi. Jika beralih ke lintasan yang lebih rendah maka akan
memancarkan energi.
Kelebihan
atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat
berpindahnya elektron. Kelemahan model atom ini adalah: tidak dapat
menjelaskan spekrum warna dari atom berelektron banyak. Sehingga
diperlukan model atom yang lebih sempurna dari model atom Bohr.
Teori Atom Mekanika Kuantum
Penjelasan tentang struktur atom yang lebih lengkap diperlukan untuk mengetahui struktur yang lebih detil tentang elektron di dalam atom. Model atom yang lengkap harus dapat menerangkan misteri efek Zeeman dan sesuai untuk atom berelektron banyak. Dua gejala ini tidak dapat diterangkan oleh model atom Bohr.
Efek Zeeman
Spektrum garis atomik teramati saat arus listrik
dialirkan melalui gas di dalam sebuah tabung lecutan gas. Garis-garis
tambahan dalam spektrum emisi teramati jika atom-atom tereksitasi
diletakkan di dalam medan magnet luar. Satu garis di dalam spektrum
garis emisi terlihat sebagai tiga garis (dengan dua garis tambahan) di
dalam spektrum apabila atom diletakkan di dalam medan magnet.
Terpecahnya satu garis menjadi beberapa garis di dalam medan magnet
dikenal sebagai efek Zeeman.

pemisahan garis spektrum atomik di dalam medan magnet
Model Atom Mekanika Kuantum
Sebelumnya kita sudah membahas tentang dualisme
gelombang-partikel yang menyatakan bahwa sebuah objek dapat berperilaku
baik sebagai gelombang maupun partikel. dalam skala atomik, elektron
dapat kita tinjau sebagai gejala gelombang yang tidak memiliki posisi
tertentu di dalam ruang. Posisi sebuah elektron diwakili oleh
kebolehjadian atau peluang terbesar ditemukannya elektron di dalam
ruang.
Demi mendapatkan penjelasan yang lengkap dan umum
dari struktur atom, prinsip dualisme gelombang-partikel digunakan. Di
sini gerak elektron digambarkan sebagai sebuah gejala gelombang.
Persamaan dinamika Newton yang sedianya digunakan untuk menjelaskan
gerak elektron digantikan oleh persamaan Schrodinger yang menyatakan
fungsi gelombang untuk elektron. Model atom yang didasarkan pada prinsip
ini disebut model atom mekanika kuantum.

posisi dan keberadaan elektron di dalam atom dinyatakan sebagai peluang terbesar elektron di dalam atom
Bilangan Kuantum Utama
Dalam model atom Bohr, elektron dikatakan berada di
dalam lintasan stasioner dengan tingkat energi tertentu. Tingkat energi
ini berkaitan dengan bilangan kuantum utama dari elektron. Bilangan
kuantum utama dinyatakan dengan lambang n sebagaimana tingkat energi elektron pada lintasan atau kulit ke-n. untuk atom hidrogen, sebagaimana dalam model atom Bohr, elektron pada kulit ke-n memiliki energi sebesar
 Adapun untuk atom berelektron banyak (terdiri atas lebih dari satu elektron), energi elektron pada kulit ke-n adalah
Adapun untuk atom berelektron banyak (terdiri atas lebih dari satu elektron), energi elektron pada kulit ke-n adalah  Dimana Z adalah nomor atom. Nilai-nilai bilangan kuantum utama n adalah bilangan bulat mulai dari 1.
Dimana Z adalah nomor atom. Nilai-nilai bilangan kuantum utama n adalah bilangan bulat mulai dari 1.
n = 1, 2, 3, 4, ….
Bisa dikatakan bahwa bilangan kuantum utama
berkaitan dengan kulit elektron di dalam atom. Bilangan kuantum utama
membatasi jumlah elektron yang dapat menempati satu lintasan atau kulit
berdasarkan persamaan berikut.
Jumlah maksimum elektron pada kulit ke-n adalah 2n2
Bilangan Kuantum Orbital
Elektron yang bergerak mengelilingi inti atom
memiliki momentum sudut. Efek Zeeman yang teramati ketika atom berada di
dalam medan magnet berkaitan dengan orientasi atau arah momentum sudut
dari gerak elektron mengelilingi inti atom. Terpecahnya garis spektum
atomik menandakan orientasi momentum sudut elektron yang berbeda ketika
elektron berada di dalam medan magnet.
 Tiap
orientasi momentum sudut elektron memiliki tingkat energi yang berbeda.
Meskipun kecil perbedaan tingkat energi akan teramati apabila atom
berada di dalam medan magnet. Momentum sudut elektron dapat dinyatakan
sebagai
Tiap
orientasi momentum sudut elektron memiliki tingkat energi yang berbeda.
Meskipun kecil perbedaan tingkat energi akan teramati apabila atom
berada di dalam medan magnet. Momentum sudut elektron dapat dinyatakan
sebagai Dimana
Dimana Bilangan l disebut bilangan kuantum orbital. Jadi, bilangan kuantum orbital l menentukan besar momentum sudut elektron. Nilai bilangan kuantum orbital l adalah
Bilangan l disebut bilangan kuantum orbital. Jadi, bilangan kuantum orbital l menentukan besar momentum sudut elektron. Nilai bilangan kuantum orbital l adalah
l = 0, 1, 2, 3, … (n – 1)
misalnya, untuk n = 2, nilai l yang diperbolehkan adalah l = 0 dan l = 1.
Bilangan Kuantum Magnetik
Momentum sudut elektron L merupakan sebuah vektor. Jika vektor momentum sudut L
diproyeksikan ke arah sumbu yang tegak atau sumbu-z secara tiga dimensi
akan didapatkan besar komponen momentum sudut arah sumbu-z dinyatakan
sebagai Lz. bilangan bulat yang berkaitan dengan besar Lz adalah m. bilangan ini disebut bilangan kuantum magnetik. Karena besar Lz bergantung pada besar momentum sudut elektron L, maka nilai m juga berkaitan dengan nilai l.
m = −l, … , 0, … , +l
misalnya, untuk nilai l = 1, nilai m yang diperbolehkan adalah −1, 0, +1.
Gambar
Bilangan Kuantum Spin
Bilangan kuantum spin diperlukan untuk menjelaskan
efek Zeeman anomali. Anomali ini berupa terpecahnya garis spektrum
menjadi lebih banyak garis dibanding yang diperkirakan. Jika efek Zeeman
disebabkan oleh adanya medan magnet eksternal, maka efek Zeeman anomali
disebabkan oleh rotasi dari elektron pada porosnya. Rotasi atau spin
elektron menghasilkan momentum sudut intrinsik elektron. Momentum sudut
spin juga mempunyai dua orientasi yang berbeda, yaitu spin atas dan spin
bawah. Tiap orientasi spin elektron memiliki energi yang berbeda tipis
sehingga terlihat sebagai garis spektrum yang terpisah.

garis spektra atom yang terpisah di dalam medan magnet berasal dari spin elektron
Sz = msћ
Dimana

Spin ke atas dinyatakan dengan

Spin ke bawah dinyatakan dengan

Atom Berelektron Banyak
Model atom mekanika kuantum dapat digunakan untuk
menggambarkan struktur atom untuk atom berelektron banyak. Posisi atau
keadaan elektron di dalam atom dapat dinyatakan menggunakan seperangkat
(empat) bilangan kuantum. Misalnya, elektron dengan bilangan kuantum n = 2, l = 1, m = −1 dan ms = −½ menyatakan sebuah elektron pada kulit L, subkulit p, orbital −1 dengan arah spin ke bawah.